相关法规
|
《医疗器械监督管理条例》
|
国务院令第680号
|
|
《医疗器械注册管理方法》
|
国家食品药品监督管理总局第4号
|
|
《体外诊断试剂注册管理方法》
|
国家食品药品监督管理总局第5号
|
|
《医疗器械说明书和标签管理规定》
|
国家食品药品监督管理总局第6号
|
|
《医疗器械生产监督管理方法》
|
国家食品药品监督管理总局第7号
|
|
《医疗器械经营监督管理方法》
|
国家食品药品监督管理总局第8号
|
|
《医疗器械分类规则》
|
国家食品药品监督管理总局第15号
|
|
《医疗器械临床试验质量管理规范》
|
国家食品药品监督管理总局第25号
|
|
关于公布医疗器械注册申报资料要求和批准证明文件格式的公告
|
国家食品药品监督管理总局公告2014年第43号
|
|
关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告
|
国家食品药品监督管理总局公告2014年第44号
|
|
《医疗器械产品技术要求编写指导原则》
|
国家食品药品监督管理总局通告2014年第9号
|
|
略......
|
|
NMPA认证登记注册程序:
1.编写产品标准。
2.与NMPA检测中心协调并获得检测报告
3.如有需要须进行临床试验。
4.向NMPA提交申请。
5.NMPA技术文件审查。
6.获得NMPA注册。
医疗NMPA认证需提交资料:
(一)境内医疗器械注册申请表;
(二)医疗器械生产企业资格证明:营业执照副本;
(三)适用的产品标准及说明:
采用国家标准、行业标准作为产品的适用标准的,应当提交所采纳的国家标准、行业标准的文本;注册产品标准应当由生产企业签章。
生产企业应当提供所申请产品符合国家标准、行业标准的声明,生产企业承担产品上市后的质量责任的声明以及有关产品型号、规格划分的说明。
这里的“签章”是指:企业盖章,或者其法定代表人、负责人签名加企业盖章(以下涉及境内医疗器械的,含义相同);
(四)产品全性能检测报告;
(五)企业生产产品的现有资源条件及质量管理能力(含检测手段)的说明;
(六)医疗器械说明书;
(七)所提交材料真实性的自我保证声明:
应当包括所提交材料的清单、生产企业承担法律责任的承诺。
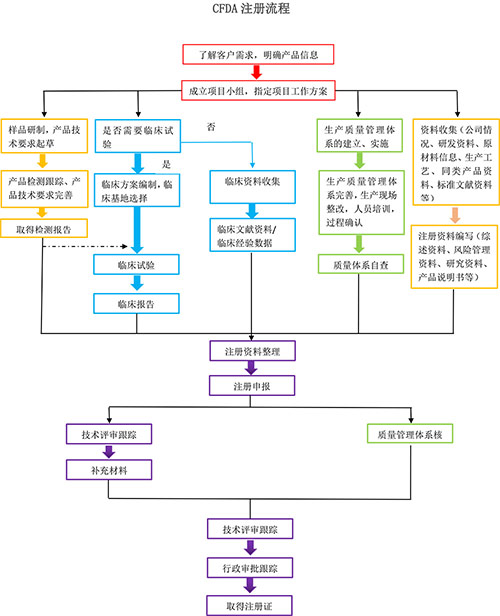
企业准备的注册资料中,主要分为四个方面:产品检测相关、临床相关、体系相关、其他技术资料。在临床、体系及其他技术资料方面,很多企业的注册人员都能一一解决,而产品检测往往是企业注册过程中一大难题。基于此情况,并结合目前国内注册检验的发展趋势,
华通威提供如下服务:
1.样品研制时华通威提供研发介入服务。
在产品设计开发初期,把标准及测试要求(如安规结构的要求、EMC的要求、元器件选材的要求),导入到产品研制中,避免研制的样机出现不符合标准或测试要求的情况,导致重新改板或开模具。同时样品研制后,正式测试前,提供预检及再整改服务。
2.产品技术要求核对与验证服务。
对于产品技术要求是否合理、齐全进行确认。对产品是否能达到技术要求中的指标进行验证,并不断完善
3.产品注册检验或发补出具检测报告服务
根据注册要求及审批中心意见,进行国内注册检验并出具报告直接用于注册,包括但不限于电气安全、电磁兼容、生物相容、环境测试、国/行标检测等。(目前部分省市已开始接受第三方检测报告,华通威已帮助多家企业出具二类注册用报告并通过审批中心审核)






